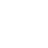
El virus del sarampión dispone de una maquinaria que, cuando entra en contacto con una célula humana, se despliega de manera precisa para fusionarse con la membrana de la célula huésped y, una vez que se completa el proceso de fusión, la célula huésped queda completamente invadida por el virus.
Científicos del Centro de Innovación en Vacunas del Instituto La Jolla de Inmunología (LJI) en Estados Unidos trabajan para desarrollar nuevas vacunas y tratamientos que detengan este proceso de fusión y, recientemente, los investigadores utilizaron una técnica de imagen llamada microscopía crioelectrónica para mostrar, con un detalle sin precedentes, cómo un potente anticuerpo puede neutralizar el virus antes de que complete la fusión.
“Lo emocionante de este estudio es que hemos capturado imágenes del proceso de fusión en acción”, señaló la profesora Erica Ollmann Saphire, quien colideró el estudio junto a Matteo Porotto, profesor de Patogénesis Viral Molecular en la Universidad de Columbia y añadió: “La serie de imágenes es como un libro animado donde vemos cómo se despliega la proteína de fusión, y luego observamos cómo el anticuerpo la bloquea antes de que complete el último paso de la fusión. Creemos que otros anticuerpos contra otros virus podrían actuar de la misma manera, aunque no han sido visualizados así antes”.
Este trabajo podría ser importante para combatir otras enfermedades virales, ya que el virus del sarampión es solo uno de los miembros de la familia de los paramixovirus, que también incluye al mortal virus Nipah. Aunque el virus Nipah es menos contagioso, su tasa de mortalidad es mucho mayor. “Lo que aprendamos sobre el proceso de fusión puede ser relevante para el virus Nipah, los virus de la parainfluenza y el virus Hendra”, afirmó Dawid Zyla, autor principal del estudio e investigador postdoctoral en LJI y dijo además que “todos estos virus tienen potencial pandémico”.
Un anticuerpo terapéutico para prevenir o tratar el sarampión
Saphire indicó que el sarampión causa más muertes infantiles que cualquier otra enfermedad prevenible por vacunación, y es también uno de los virus más infecciosos conocidos, mientras que Zyla manifestó que no solo los niños pequeños están en riesgo, ya que “la vacuna actual funciona bien, pero no puede ser administrada a personas embarazadas o con sistemas inmunitarios comprometidos”.
Además, no existe un tratamiento específico para el sarampión, por lo que los investigadores están buscando anticuerpos que se puedan usar como tratamiento de emergencia para prevenir cuadros graves. Para comprender mejor cómo el virus del sarampión se fusiona con las células, el equipo de LJI estudió un anticuerpo llamado mAb 77. Los investigadores encontraron que el mAb 77 se dirige a la glicoproteína de fusión del sarampión, la pieza de maquinaria viral que el sarampión usa para introducirse en las células humanas a través de un proceso especializado llamado fusión.
Los investigadores comprobaron que mAb 77 detiene el virus en medio del proceso de fusión, cuando la glicoproteína de fusión ya está parcialmente “plegándose” en la conformación correcta para completar la fusión de la membrana. Finalmente, estos científicos pudieron ver exactamente cómo mAb 77 une piezas de la glicoproteína de fusión para prevenir la infección viral. “Fue sorprendente ver cómo es realmente este paso intermedio en el proceso de fusión”, señaló Zyla.
Ahora que saben cómo funciona el mAb 77, los investigadores esperan que el anticuerpo se pueda utilizar como parte de un cóctel terapéutico para proteger a las personas contra el sarampión o para tratar a pacientes con infección activa por sarampión. En un experimento de seguimiento, los científicos demostraron que mAb 77 proporcionaba una protección significativa contra el sarampión en modelos de infección por el virus del sarampión en ratas algodoneras. Las ratas algodoneras tratadas previamente con mAb 77 antes de la exposición al virus no mostraron infección, o mostraron signos reducidos de infección en su tejido pulmonar.
El próximo objetivo de los investigadores
El siguiente objetivo de Saphire y Zyla es estudiar diferentes anticuerpos contra el sarampión. “Nos gustaría detener la fusión en diferentes puntos del proceso e investigar otras oportunidades terapéuticas”, afirma Zyla, que también planea seguir colaborando con investigadores del sarampión en la Universidad de Columbia, ya que asegura que “la combinación de la experiencia en biología estructural de LJI y la experiencia en biología celular y virología de Columbia fue clave para impulsar este proyecto”.
El equipo de LJI necesitaba crear una versión de la glicoproteína de fusión del sarampión lo suficientemente estable como para ser observada con un microscopio crioelectrónico. Para hacerlo, Zyla trabajó con científicos en un laboratorio de la Universidad de Columbia, quienes habían descubierto algunas mutaciones extrañas en una variante del sarampión que atacaba el sistema nervioso central. Esta variante mutada tenía puntos débiles en su estructura de glicoproteína de fusión y estas debilidades forzaban al virus a evolucionar. “El virus tiene que mutar para entrar en el cerebro, pero luego necesita estas mutaciones estabilizadoras para compensar”, dijeron los expertos.
Gracias a estos descubrimientos en Columbia, Zyla tenía un plano útil para diseñar una glicoproteína de fusión con estas mismas mutaciones estabilizadoras. Esta nueva glicoproteína de fusión podía producirse en masa en cultivos celulares y era lo suficientemente robusta para investigaciones estructurales. “Obtuvimos rendimientos extremadamente buenos de la glicoproteína, lo que también nos permitió hacer estudios de biología estructural, bioquímica y biofísica”, indicó.
Luego, los investigadores comenzaron a capturar imágenes con la ayuda del Núcleo de Microscopía Crioelectrónica de LJI y las nuevas imágenes mostraron la glicoproteína de fusión en “complejo” con mAb 77. Los investigadores descubrieron que mAb 77 detiene el virus en medio del proceso de fusión, cuando la glicoproteína de fusión está ya parcialmente “plegada” en la conformación correcta para completar la fusión de membranas. Finalmente, los investigadores pudieron ver exactamente cómo mAb 77 bloquea piezas de la glicoproteína de fusión para prevenir la infección viral. “Fue impactante ver cómo se ve este paso intermedio en el proceso de fusión”, dice Zyla.